投稿者:はっちん
元記事= https://www.mdpi.com/2076-393X/9/2/147/htm
SARS-CoV-2 mRNAワクチン:免疫機構とその先
by エミリー・ベッチーニそしてミケラ・ロッチ *
ペンシルベニア大学ペレルマン医学部微生物学科、フィラデルフィア、PA 19104、米国*
対応する相手の作成者。
アカデミック・エディター:スティーブン・M・ヴァルガ
ワクチン2021、9(2)、147; https://doi.org/10.3390/vaccines9020147
受付日:2021年1月8日/改訂:2021年1月29日/受付:2021年2月6日/発行:2021年2月12日
(この記事は、mRNAワクチンの過去、現在、未来の特集に属しています)
要約
病原体感染から保護するためには、ワクチンはB細胞およびT細胞応答を含む効率的な適応免疫を引き出さなければならない。B細胞応答は重要ですが、抗体依存性保護を媒介することができるため、T細胞はB細胞活性を調節し、病原体感染細胞の排除に直接寄与する可能性があります。呼吸器疾患コロナウイルス2(COVID-19)の原因物質である重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)に対する効果的なワクチンを開発する前例のないレースでは、メッセンジャーRNA(mRNA)ワクチンは、迅速な発達能力と強力な適応免疫応答を駆動する能力のおかげでフロントランナーとして登場しました。本レビュー記事では、動物モデルにおける前臨床試験の結果と、ワクチン接種後の適応免疫応答に主に焦点を当てて、SARS-CoV-2 mRNAワクチンの有効性を評価したヒトの臨床研究の概要を提供する。
1. はじめに
2019年12月、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)をβコロナウイルスに、衰弱性コロナウイルス病2019(COVID-19)の原因物質として同定した。このレビューが書かれた時点(2020年12月)、この病気は世界中で8000万人以上の感染と180万人の死亡につながり、安全で効果的なワクチンを開発する重要な必要性を強調しました。これまでに、臨床評価の対象としてSARS-CoV-2ワクチン候補は61人、前臨床開発では172例[2]がある。SARS-CoV-2の1つ以上の成功したワクチンを生成するためのこの前例のない努力では、多くの異なるワクチンプラットフォームが展開されています。現在調査中の候補のいくつかは、不活性化/生減衰ウイルスまたは組換えタンパク質(3[」で詳述)などの伝統的なワクチンアプローチに基づいています。他の人は、抗原自体ではなく、抗原を生成するために遺伝情報を提供する核酸ベースのメッセンジャーRNA(mRNA)ワクチンのような新しい有望なプラットフォームを利用しています。従来のワクチンアプローチは何十年もの間安全かつユビキタスに使用されてきましたが、mRNAワクチン接種の未知数は多く、これはmRNAワクチンのファーストクラスのライセンスです。mRNAワクチンの設計戦略の重要な側面について簡単に議論した後、このレビューは、多くの異なるグループからの動物研究に基づくSARS-CoV-2 mRNAワクチンに対する適応免疫応答に関する現在の知識を強調する。 モデルナ(米国マサチューセッツ州ケンブリッジ)と国立アレルギー・感染症研究所ワクチン研究センターが共同開発したSARS-CoV-2 mRNAワクチンmRNA-1273から入手可能な臨床データと、ビオンテック(マインツ、ドイツ)/ファイザー(ニューヨーク市)のBNT162b1およびBNT162b2と共に入手可能な臨床データ(また、mRNAワクチンの使用に伴う主な長所と課題についても、ここで説明します。また、現在臨床開発中の有望な自己複製RNA候補は存在するが、このレビューはSARS-CoV-2 mRNAワクチン候補のみに焦点を当てることに留意しなければならない。
2. SARS-CoV-2 mRNAワクチンの設計戦略
mRNAワクチンの概念化は、mRNAワクチンの単純な手口のために、最初は非常に簡単に見えるかもしれません。標的抗原をコードするmRNAワクチンを送達すると、細胞はmRNAを取り込み、それをその時点でタンパク質に翻訳します。その後、個人の免疫系は、標的タンパク質に対して強い適応免疫応答を取り付けます。しかし、mRNAワクチンの実際の設計プロセスには、反応原性を低減し、タンパク質発現を最適化するためのmRNA修飾の重要な検討が必要です。標的抗原の適切な選択;効率的な送達を可能にする最適な製剤[4]。
2.1. mRNAへの変更
mRNAワクチンの開発において考慮すべき最初の側面は、未修飾のmRNA自体がワクチン開発における使用にとって理想的ではない[4]である。実際、mRNAは非常に不安定であり、好ましくない環境では急速に分解されます。さらに、免疫原性が高く、さまざまな病原体関連分子パターンセンサを活性化することができます。半減期と翻訳性と安全性を向上させるために、カリコらは、シュードリジン、5-メチルシチジン、N6-メチルアデノシン、5-メチルウリジン、2-チオウリジン[5]を含むmRNA分子中のヌクレオシドに対する様々な天然の修飾をテストした。これらの変異体のうち、ウリジンの代わりにN1-メチル-シュードリジン(m1つかりません)を組み込むことで、未修飾mRNAに対する翻訳が10倍に増加することがわかりました。さらに、この修飾を有するmRNA分子が、トール様受容体(TR)やレチノイン酸誘導性遺伝子I(RIG-I)[4,5]などの病原体関連分子パターンセンシング機構を引き起こさないことを示すことができた。これは、過度の炎症を避けるために重要であり、望ましくないワクチンの副作用をもたらす可能性があります。これらの理由から、最近認可されたmRNAワクチンmRNA-1273およびBNT162b2を含む多くの候補は、ワクチン設計においてこのm1わらなかったmRNA修飾を採用した[6、7、8、9、10、11、12、13、14、15、16]。ここで注意することは、ワクチンメーカーがmRNA分子に適用できる他の潜在的な変更がありますが、m1ワクチンは最もユビキタスに使用される修飾であり、このレビューで議論される唯一のmRNA修飾であることに注意することが重要です。
2.2. 抗原選択
mRNAワクチンの抗原を選択する際には、免疫原性と保護免疫応答を引き出すことができる標的を選択することが不可欠です。SARS-CoV-2上の複数エピトープのうち、スパイク(S)糖タンパク質は、COVID-19ワクチン開発のために一般的に選択される標的である[3]、主要なSARS-CoV-2表面タンパク質であるため、宿主細胞内のアンジオテンシン変換酵素2(ACE2)受容体に結合してウイルスエントリを媒介する[17、18、19]。SARS-CoV-2 Sは、このコロナウイルスに特有のフリン切断部位によって結合される受容体結合サブユニット(S1)と融合サブユニット(S2)からなる第1種ウイルス融合糖タンパク質である(図S1)[18,20]。Sは、このふれうるみサイトで翻訳後に切断されています。しかし、S1およびS2サブユニットは、Sが受容体結合ドメイン(RBD)を介してACE2受容体に結合するまで関連付けされたままであり、不可逆的な立体構造変化および膜融合をもたらす。同様の融合糖タンパク質を用いた以前の研究から収集された情報は、効果的なワクチンの開発のために中和感受性エピトープを保存する前注入安定化タンパク質を使用することがいかに重要であるかを示している[21,22]。Sタンパク質を安定化させるために、いくつかの異なる戦略が採用されている(図S1)。アミノ酸986および987がプロリン(S-2P)に置換される変異であり、プレフュージョンコンフォメーションにおける膜貫通S糖タンパク質を安定化させるが、S1およびS2サブユニットの切断を可能にする[17,21]、は、ライセンスワクチンmRNA-1273およびBNT162b2[6,7,8,9,10,11,12,15,16]で使用されるアプローチである。もう一つのアプローチは、全長Sタンパク質がフリン切断部位(Δfurin)を欠き、翻訳後に切断することができないmRNA構築物を設計することから成る[23,24]。
全長Sタンパク質の代替として、RBDはmRNAワクチン(図S1)によって抗原として独占的に標的化することができ、いくつかの研究では、多くの中和エピトープがRBD[25、26、27、28、29]に含まれていることが示されています。もともとBioNTech/ファイザーによって開発され、初期の臨床試験でテストされた臨床候補の一つ, BNT162b1 [13,14,15], 分泌された三量体化RBDをコード化.フルレングス S または RBD のどちらかを選択すると、異なる利点があります。例えば、RBDはSARS-CoV-2中和にとって重要なエピトープに富んでいるが、全長Sは特に大きなタンパク質であり、より広範な適応免疫応答を引き出すために重要である可能性のある追加のエピトープが含まれている。
2.3. mRNAの配信
最後に、裸のmRNAは予防接種のために直接注射することができるが、この送達方法はかなり非効率的である。実際、mRNA分子は、転写物をタンパク質に翻訳するのに必要な機械に到達するために、細胞の脂質膜に浸透できる必要があります。したがって、mRNAワクチンの細胞質の局在化を促進する送達方法は、効率的なタンパク質翻訳を達成するために重要である。初期の研究では、標準的な実験室の脂質カプセル化法、例えばリポフェクタミン[5]は、インビトロの適用のためにうまくいった。しかし、これらの方法は、生体内で試験した場合に効力が限られており、また、細胞傷害性が高いことも判明した[4]。脂質ナノ粒子(LNP)カプセル化の出現は、MRNAワクチンの開発の転換点であり、LnPは生体内でmRNAを効率的に送達することができる[30,31]。筋肉内注射すると、mRNA-LNPは、注射部位とリンパ節の排出の両方において抗原提示細胞によって内部化され、迅速に翻訳され、適応免疫応答の開始を促進する[32]。さらに、LNP はヌクレアーゼによる分解から mRNA を保護できます。多くのワクチン開発者が使用するLNPの正確な組成は独自の情報ですが、LnPにはイオン化可能なカチオン脂質、コレステロール、リン脂質およびPEGの組み合わせが含まれていることが知られており、mRNA[33,34,35]をカプセル化する約100nmナノ粒子に自己集合します。臨床試験のワクチン候補のうち、LnPはmRNAワクチンを参加者に導入するために使用されている標準的な方法です。SARS-CoV-2前臨床または臨床候補で使用されない追加の送達方法は、他の場所で徹底的に見直されている[4]。
3. SARS-CoV-2 mRNAワクチンによって引き出される免疫応答:動物研究からの教訓
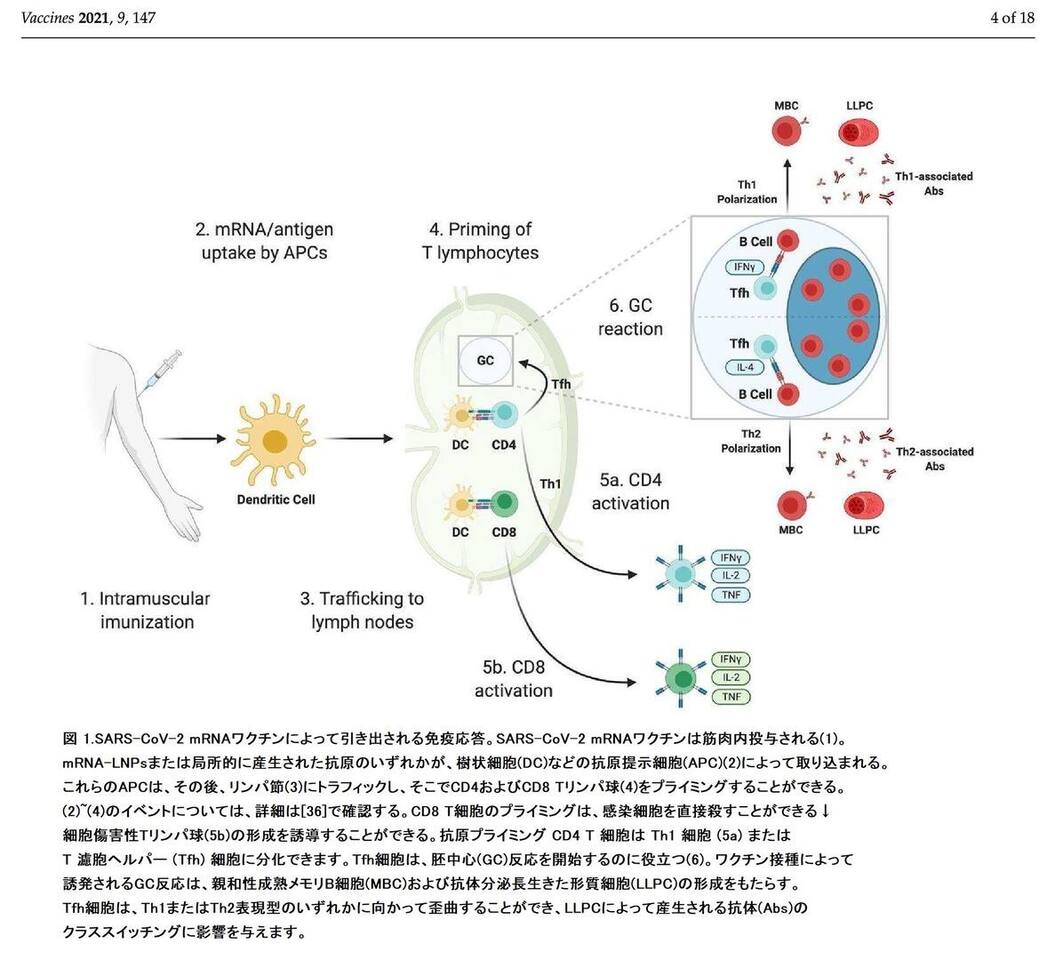
SARS-CoV-2 mRNAワクチンによって引き出される免疫応答の概略表現は、このセクションで議論される動物実験のデータに基づいて構築され、図1に示されている。mRNAワクチンの取り込み/生体分布およびmRNAワクチンに対する自然免疫応答は、適応免疫の開始に不可欠であるが、これらのプロセスは他の場所で徹底的に見直され、SARS-CoV-2 mRNAワクチンの文脈で生成された利用可能なデータの欠如のためにこの記事では取り上げません。
【図1】Vaccines 09 00147 g001 550図 1.SARS-CoV-2 mRNAワクチンによって引き出される免疫応答。
SARS-CoV-2 mRNAワクチンは筋肉内投与される(1)。mRNA-LNPsまたは局所的に産生された抗原のいずれかが、樹状細胞(DC)などの抗原提示細胞(APC)(2)によって取り込まれる。これらのAPCは、その後、リンパ節(3)にトラフィックし、そこでCD4およびCD8 Tリンパ球(4)をプライミングすることができる。(2)~(4)のイベントについては、詳細は[36]で確認する。CD8 T細胞のプライミングは、感染細胞を直接殺すことができる細胞傷害性Tリンパ球(5b)の形成を誘導することができる。抗原プライミング CD4 T 細胞は Th1 細胞 (5a) または 濾胞性ヘルパーT (Tfh) 細胞に分化できます。Tfh細胞は、胚中心(GC)反応を開始するのに役立つ(6)。ワクチン接種によって誘発されるGC反応は、親和性成熟メモリB細胞(MBC)および抗体分泌長生きた形質細胞(LLPC)の形成をもたらす。Tfh細胞は、Th1またはTh2表現型のいずれかに向かって歪曲することができ、LLPCによって産生される抗体(s抗体)のクラススイッチングに影響を与えます。
3.1.B細胞と抗体応答
ほとんどの認可されたワクチンは、時間の経過とともに持続する保護抗体(抗体)応答を引き出すことによってウイルス感染からの保護を与える[37]。ウイルスに対する親和性成熟した長持ちする抗体は、生殖中心(GC)という二次リンパ器官の微小解剖学的部位で生成される[38] 。GCでは、抗原活性化B細胞はランダム突然変異を起し、免疫グロブリン遺伝子を多様化して、病原体に対する親和性の高い抗体を生成する。次に、アポトーシスから積極的に選択され、救出される、より高い親和性を獲得したB細胞のみである。この洗練されたダーウィニアンプロセスは、最終的には高親和性の長命形細胞(LLPC)とメモリB細胞(MPC)の形成につながります。LLPCは抗体を分泌し、その一部は抗体(中和s抗体)を中和しており、殺菌免疫を媒介する可能性がある[39]。重要なことに、LLPCは何年も、あるいは場合によっては数十年も生存し、さらなる抗原刺激を必要とせずにs抗体を継続的に分泌する[40]。逆に、MMBCsは、その後の病原体暴露の際に活性化され、高親和性抗体-分泌細胞の新たなバーストを生じさせる[39]。したがって、LLPCとMBCの両方がワクチン接種によって誘導する望ましい細胞型である。
3.1.1. SARS-CoV-2 結合および中和抗体の誘導
ヒトにおける自然感染の研究は、SARS-CoV-2に感染した個人が強力な中和抗体(SARS-CoV-2 Sタンパク質を標的とする)を産生し、体外および/または生体内での感染を阻害する可能性があることを示している[29,41]。この知見に基づいて、SARS-CoV-2 mRNAワクチンの前臨床評価は、ワクチンの有効性を評価する最初のステップとして、マウスにおける堅牢なSARS-CoV-2結合および中和抗体応答を引き出すこれらのワクチンの能力に焦点を当ててきた。我々のグループが行った研究は、mRNA-LNPワクチンの単一の30μg用量が、全長のΔfurin SまたはSARS-CoV-2のRBD(図S1)をコードし、免疫後2週間の早い時期にマウスの高SARS-CoV-2結合免疫グロブリンG(IgG)抗体を促進することができたことを示した[23,24]。高いワクチン用量が私たちの研究で利用されているにもかかわらず[23,24]、臨床候補mRNA-1273(モデルナ)、BNT162b2(ビオンテック/ファイザー)およびCVnCoV(CureVac、フランクフルト、 ドイツ)))、全長のプレ融合安定化Sタンパク質(図S1)[8、12、42]およびARCoV[43]をコードし、RBDをコードし、SARS-CoV-2特異的抗体の産生は、マウスのこれらのワクチン候補の有意に低い用量(0.2〜10μgの範囲)によって駆動されたと報告した。重要なことに、様々なグループは、これらのSARS-CoV-2 mRNAワクチンによって誘発された抗体応答がインビトロでウイルスを中和できることを発見した。 疑似ウイルスとSARS-CoV-2ベースの中和アッセイ[8、12、23、24、42、43、44、45]の両方で測定し、中和抗体レベルが2ヶ月間持続し、それ以上の免疫後[23、24、44、45]。異なるワクチン投与によって引き出された抗体応答の分析は、mRNAワクチンが、ブースター免疫によって増強されたプライミング時に用量依存性のSARS-CoV-2特異的抗体応答を誘導したことを示した[8,24,42,43]。高いワクチン用量(30μg)を用いた単一の免疫は、マウスで体液反応の上昇を促進するのに十分に現れたが[23,24]、低いワクチン投与量(1μgまたは2μg)での中和抗体生成には、ブースター免疫が必要であった[8、42、43]。全体として、これらの異なるマウス研究からのデータは、SARS-CoV-2 mRNAワクチンによる免疫化後に検出可能な中和抗体レベルに達するために、高用量のmRNAまたはブースター免疫のいずれかが必要である可能性があることを示唆している。興味深いことに、抗原の選択は、SARS-CoV-2 S1 mRNAワクチン(図S1)がRBD mRNAワクチンほどSARS-CoV-2-結合s抗体および中和s抗体を誘導するのに有効ではなかったという研究で示されるように、抗体応答を促進するワクチンの能力に影響を与えるようです[45].これは、SΔfurin[23,24]またはS-2P構造[8,12,42]のいずれかをコードするmRNAワクチンを利用した他のいくつかの群によって観察される強力な体液性応答とは異なり、S1およびS2サブユニットが両方とも存在する全長Sが単純なS1サブユニットよりも優れた免疫原である可能性があることを示唆している。
マウス以外の研究では、野生型ウイルスはウイルス感染を開始するための適切な受容体の欠如のために、一般的な実験室マウス株で効率的に複製できないため、非ヒト霊長類(NHP)の研究は、SARS-CoV-2のワクチン候補の有効性を決定するのに役立つ[46]。NHPでは、臨床候補mRNA-1273(10または100μg)およびBNT162b2(30または100μg)は、2回の予防接種後にSARS-CoV-2特異的抗体を引き出す堅牢な用量依存能力を示した[7,12]。また、これらのs抗体のインビトロ中和能力についても同様の傾向が認められ、BNT162b2によってNHPで中和抗体値が引き出され、SARS-CoV-2回復期ヒトセラ[12]の値よりもさらに高かった。候補CVnCoVは、はるかに低用量(0.5または8 μg)で試験されたが、より高い用量だけが、単一の免疫化後に有意なレベルのS-およびRBD結合IgG力価を引き出し、時間の経過とともに増加した[47]。いずれの場合も、これらの候補によって引き出された中和抗体応答は、ブースター免疫後のSARS-CoV-2チャレンジに対するインビボ保護と組み合わされた[7,12,47]。ウイルス複製は、これらのワクチンのいずれかを受けた感染動物の上気道で検出されたが、それは一過性であり、数日間しか測定できなかった。重要なことに、免疫されたNHPの下気道は、いつでも気管支肺胞洗浄液中の測定可能なSARS-CoV-2サブゲノムRNAの欠如によって示されるように、ウイルス複製から完全に保護された[7]。これらの研究はまた、より高いワクチン用量が上気道のより大きな保護を与え、両方の用量が下気道を保護するのに等しく有効であることを示した[7,12]。
コロナウイルスワクチンの開発には、抗体産生の質に関しては注目すべき懸念がある。1つの懸念は、SARS-CoV-2ワクチンが抗体依存性増強、ワクチン誘発s抗体が不十分な濃度/親和性のためにウイルスを効果的に中和できない場合に起こりうる現象、または間違った特異性[48]の開発を支持するかもしれないということです。SARS-CoV-2感染で抗体依存的な増強が起こり得るという証拠はないが、上記で議論されたすべてのSARS-CoV-2 mRNAワクチンによって駆動されるSARS-CoV-2結合s抗体および中和s抗体の堅牢なレベルは、NHPのインビボ保護データと組み合わせることで、抗体依存増強の可能性を避けるために有利に見える。
3.1.2. 胚中心由来B細胞応答
GC反応は、長期間にわたって保護を与えることができる高品質のB細胞応答を生成するための基本である。我々のグループのデータは、全長Δfurin Sタンパク質またはRBDのいずれかをコードするSARS-CoV-2 mRNAワクチンの単一の30 μg用量が、マウスにおける7日間の一次GCの堅牢な形成を促進できることを実証した[24]。これは、より伝統的な組換えRBD(rRBD)タンパク質ワクチンによる免疫に応じて最小限のGC誘導に反対し、MF59様アジュバントAddaVax(rRBD-AddaVax)で処方された。本研究では、GCをフローサイトメトリーと顕微鏡の両方で評価した。同様に、マウスにおけるSARS-CoV-2 mRNAワクチンによるGC誘導も、2つの追加研究によって記載された:フォーゲルら。 脾臓および排出リンパ節の両方でGCB細胞の有意な増加を示した BNT162b2[12]の単一の5μg投与量で免疫した後12日目に、Tai et al.[45]は、30μgの用量のSARS-CoV-2mRNAワクチンでのブースター免疫接種の10日後にGCの存在を観察した。
我々の研究では、mRNAワクチンの単回投与によって引き出されたGC B細胞はSARS-CoV-2特異的であり、7日目頃にピークを迎え、その後徐々に衰退し、主に28日目までに解決された[24]。このようなgc運動は、mRNAワクチンに応答して、アジュバント中のタンパク質抗原に対する一次GC応答が通常10日から14日目の免疫後にピークを迎える[49]と考えられる。興味深いことに、免疫後の週4でGCの定量的な減少があったが、この時点でSARS-CoV-2特異的GC B細胞の頻度が上昇した場合、mRNAワクチンに応答していくつかの残留低レベルGC活性がまだ存在することを示した。この残留GC活性は、高いSARS-CoV-2特異的IgGの活性化に寄与し、中和s抗体は、免疫後60日を発見した[24].さらに、ブースター免疫は、10日後のブーストを測定したSARS-CoV-2-specifc GC B細胞形成の第2の波をもたらした。
上で論じたように、ワクチン接種によって生成する最も望ましいB細胞集団は、アフィニティー成熟したLLPCおよびMBCであり、細胞型はGC反応を通じてカノン的に生成される。我々のグループの最近の2つの研究では、LLPCの分析から始めて、SARS-CoV-2 mRNAワクチンによる単一の免疫によってマウスで生成されたGC由来B細胞応答を調べた[23,24]。具体的には、9週前に免疫したマウスの骨髄におけるSARS-CoV-2特異的抗体-分泌細胞の高レベルを、SARS-CoV-2 mRNAワクチンで観察した。分析の場所と時間のポイントのために、これらのデータは、GC反応に続くLLPCの正常な生成を示すものでした。これらの研究では、SARS-CoV-2特異的MMBCsもmRNAワクチンを用いた免疫後の評価を行った。免疫応答の初期段階における記憶前駆体(GCライトゾーンにおけるCCR6発現細胞)の検出と一致して、我々はさらに、抗原特異的なクラススイッチMBC60日のワクチン接種後に測定可能なプールがあることを実証した[23,24]。
Ledererらから出てきたデータはさらに、SARS-CoV-2 mRNAワクチンによるワクチン接種が、マイクロ中和および疑似中和アッセイの両方で測定されたrRBD-AddaVaxと比較してより効率的な中和抗体産生をもたらしたことをさらに示した[24]。重要なことは、GC応答の大きさとSARS-CoV-2ワクチン接種によって誘導される中和s抗体のレベルとの間に強い相関関係を観察し、SARS-CoV-2に対する中和応答のためにGCの形成が必要である可能性を示唆した。GC反応を予防接種時の効率的な中和抗体応答に結びつける我々の発見は、明らかにヒトのSARS-CoV-2自然感染のデータと不一致であることは注目に値する。いくつかの研究は確かに強力なインビトロ中和活性を有する生殖細胞系列中和s抗体がSARS-CoV-2感染の間に誘発され、低品位突然変異によって特徴付けられることを説明している[27、50、51、52]。これらのデータは、そのような中和s抗体の生成に関与する限定的なGCプロセスを示す。それにもかかわらず、GCはアフィニティー成熟プロセスを抱えるだけでなく、長期間生き生きと耐久性のある抗体生産を仲介するLLPCを生成するためにも重要であることを覚えておくことが重要です。したがって、生殖細胞系に近い中和s抗体を産生する形質細胞の寿命が限られている可能性があります。感染時のSARS-CoV-2に対する抗体応答の長寿に関する研究の大半は、感染後5〜8ヶ月でSARS-CoV-2結合IgGが中程度に減少することを示しているが[53,54]、中和s抗体の長寿に関するいくつかの矛盾する結果がある。いくつかの研究は確かにCOVID-19がゆっくりと減少中和s抗体を生成するかもしれないことを示唆した [53,54,55].逆に、他の人は時間の経過とともに中和s抗体の急激な減少を報告しました[56,57],自然なSARS-CoV-2感染は、時には限られた耐久性の中和抗体応答を引き出す可能性があることを示している可能性があります.さらに、重度のCOVID-19ドナーからのリンパ節の死後評価において、GC形成の著しい減少/欠如が最近ピライと同僚によって説明された[58]。この研究は、自然なSARS-CoV-2感染は、少なくとも最も重篤なCOVID-19症例において、GC由来の長期的な体液性免疫を効率的に生成しない可能性があることを示唆している。今後の研究は、中和抗体応答に特に重点を置いて、SARS-CoV-2自然感染によって引き起こされる抗体応答の実際の長寿を評価するために重要であるが、SARS-CoV-2 mRNAワクチンが長期的な血清学的記憶およびMMBCsを引き起こす可能性を与えるために堅牢なGC応答を誘導する可能性があることは非常に望ましいと思われる。
3.2. T 細胞応答
ワクチンによる保護は抗体応答に大きく依存するが[39]、SARS-CoV-2の有効なワクチン候補は、複数の理由からT細胞応答の誘導から大きな恩恵を受けることができる。第一に、CD4 T細胞の中で、濾胞性ヘルパーT(Tfh)細胞はGCおよび親和性成熟抗体応答の重要な調節因子である[59,60]。第二に、他のCD4 T細胞サブセットは、最適なCD8 T細胞応答を促進するなど、異なる重要な機能[39]を提供するかもしれない。第三に、顆粒剤やペルフォーリンなどの分子の放出による病原体感染細胞の直接殺死を担う細胞傷害性CD8T細胞は、保護s抗体が生産的なウイルス感染を完全に遮断できない場合に、ワクチン接種によって生成する重要な「セーフティネット」である[39]。さらに、いくつかの例において、ワクチン誘発T細胞応答はまた、保護応答[37]と相関し得る。最後に、原発性免疫不全のアガンマグロブリン血症患者の研究は、B細胞および抗体応答が適切に機能しない場合、他の細胞タイプ(T細胞を含む)が最小/中等度の疾患でSARS-CoV-2感染をクリアできるかもしれないことを示唆している[61,62]。
3.2.1. Tfh細胞(濾胞性ヘルパーT細胞)応答
Tfh細胞は、GC反応を形成する特殊なタイプのCD4 T細胞であり、GC由来B細胞応答の開発にとって非常に重要であるため、ワクチン開発者にとって特に興味深いものです。Tfh細胞は、共刺激分子とサイトカインをB細胞に送達することで、GCの形成と親和性成熟GC B細胞の選択を仲介し、LLPCまたはMBC[59,60]にさらに分化することができます。mRNA-LNPプラットフォームによるTfh細胞の有効誘導は、インフルエンザワクチン接種の文脈で前述した[31,63]。この観察がSARS-CoV-2 mRNAワクチンにまで及ぶ可能性があることを確認するために、SARS-CoV-2 mRNAワクチンまたはrRBD-AddaVaxを用いたBALB/cマウスの免疫化後のTfh細胞の誘導を評価した[24]。予想通り、mRNA-LNPプラットフォームはSARS-CoV-2ワクチンの文脈においてもTfh細胞の強力な誘導体であったのに対し、rRBD-AddaVaxはSARS-CoV-2 mRNAと比較してより控えめなTfh細胞集団を誘導したに過ぎない。SARS-CoV-2 mRNAワクチン接種後のTfh細胞の生成もTaiらによって見られたが、誘導はRBDコードmRNAワクチンでは有意であり、S1コード化mRNA[45]では有意ではなかった。さらに、Vogelら.は、リンパ節、脾臓および血液の排出におけるBNT162b2で免疫した後のTfh細胞の量の有意な増加を発見した[12]。
インターロイキン21(IL-21)は、GC B細胞および形質細胞分化の増殖を媒介し得るTfh細胞によって産生されるカノニカルサイトカインである[64]。我々の研究では、SARS-CoV-2 mRNAワクチンによって駆動されるTfh細胞集団が、SARS-CoV-2ペプチドプールによるインビトロ再刺激時のIL-21産生Tfh細胞の検出によって測定されるように、抗原特異的であることが明らかになった[24]。我々のデータに沿って、Corbett et al.はmRNA-1273がNHP免疫動物の血液中のIL-21産生循環Tfh細胞の生成を促進することができたことを示した。まとめると、これらのデータは、SARS-CoV-2に対する長期的な中和免疫を引き出すことを約束して、TfhおよびGC B細胞を協調的に誘導できるワクチンプラットフォームの重要性を指摘している。
3.2.2. CD4 T細胞の機能分極化
ワクチンによって促進されるサイトカインミリューは、CD4 T細胞の機能的分極化を導く。Tヘルパー1(Th1)歪んだ応答は、例えば、蠕虫感染の制御にとってより重要であるTヘルパー2(Th2)応答とは対照的に、ウイルスなどの細胞内病原体を制御するために必要な免疫応答のタイプであるため、ワクチン開発者にとって重要である[39]。さらに、Th2機能偏光(IL-4やIL-13などのサイトカインの分泌を特徴とする)を用いたCD4 T細胞の分化を好む呼吸器ウイルスのワクチンは、ワクチン関連強化呼吸器疾患(VAERD)に関連しているため、有害である可能性があります[48]。ヒトでは、VAERDは、不活化麻疹および呼吸器合胞体ウイルスワクチンで予防接種を受けた小児だけでなく、ミョウバンにおける不活性化ウイルスによる呼吸間性ウイルス予防接種の動物モデルにおいてのみ診断されたのみである。VAERDに関与するメカニズムには、Th2バイアス免疫応答が含まれる。現在のSARS-CoV-2 mRNAワクチンに関するVAERDの証拠は出てこないが、動物の中で熟知した不活性化SARS-CoVワクチンがVAERDを引き起こしたので、この現象を念頭に置くことは重要である[48]。
コルベットらの研究では、mRNA-1273で免疫されたマウスが主要なTh1応答(特に最も高いmRNAワクチン用量で)を有し、TH1サイトカインIFNγ、TNF、およびIL-2の産生によって測定された合計CD4 T細胞によるSARS-CoV-2ペプチドプールによる全VI4 T細胞による測定を報告した[8]。対照的に、ミョウバンの遺伝子組換えS-2Pタンパク質の前期安定化で免疫されたマウスは、IL-4、IL-5およびIL-13の産生によって示されるように、Th2バイアス応答を有する傾向があった。この知見は、複数のmRNA-LNPワクチン構築物が、肺および脾臓からの全CD4 T細胞の細胞内サイトカイン染色またはELISpotに基づいてTh1サイトカイン(IFNγ、TNF、およびIL-2を含む)の堅牢な産生を引き出すことを発見した[12,23]または全脾細胞で確認された [42]アカゲザルのワクチンBNT162b2およびmRNA-1273と同様の研究は、両方の構成体による免疫化後、合計CD4 T細胞がTh1を分泌する能力によって示されるように、Th1が高いTh1歪曲であることをさらに示した[7,12]。
Tfh細胞は機能的に異種集団である。異なる病原体またはワクチンプラットフォームが機能的プロファイルを異なる形で形成する可能性があるため、興味深い問題は、Tfh細胞の機能的特性がmRNA-LNPワクチンによってどのような調節されているかである。最近発表された研究[24] では、SARS-CoV-2 mRNA免疫マウスにおけるTfh細胞応答の質をさらに評価した。この目的のために、SARS-CoV-2ペプチドプールによるインビトロ再刺激の後、IFNγまたはIL-4の産生を特徴とするTh1またはTh2表現型に向けてTfh細胞の分極を測定した。mRNA-LNPワクチンは、フルレングスS∆フリンを免疫原として使用する場合にTfh細胞をTh1表現型に偏向させ、RBDが免疫原であるときに混合されたTh1/Th2表現型に向かって歪曲することを実証した。対照的に、rRBD-AddaVaxはTh2バイアスTfh細胞を誘導した。なお、Tfh細胞の機能的分極化は、IGG2aまたはIgG2b s抗体に対するSARS-CoV-2結合IgG1の差動比と関連しており、rRBD-AddaVaxはmRNAワクチンよりも高いIgG1/IgG2aまたはIgG1/IgG2b比を支持した[24]。これは、マウスのTh2バイアス応答がIgG1産生に関連付けられているように、予想される結果であった。逆に、Th1偏光応答はIgG2 抗体産生[65,66,67]にリンクされている。Tfh細胞応答はこの研究では評価されなかったが、mRNA-1273によって誘導されたIgG応答を、ミョウバンで配合されたS-2Pタンパク質と比較した場合のIgG1とIgG2aの相対的な比も報告された[8]。SARS-CoVモデルでVAERDを発症するマウスにワクチン誘発IgG1産生に対する歪みが見られたので、よりバランスのとれたIgG1/IgG2a比はmRNAワクチンにとって好ましい結果となる可能性がある。
これらのデータに基づいて、SARS-CoV-2 mRNA-LNPワクチンはTh1に向けて全CD4 T細胞の機能的分極化を好むのに対し、Tfh細胞はTh1(IFNγ)およびTh2(IL-4)サイトカインの両方の産生によって特徴付けられる。IL-4はTfh細胞によって産生される重要なサイトカインでもあるという考えに従って、B細胞上の抗アポトーシスヘルパー機能を仲介するので、mRNAワクチン誘発Tfh細胞がTh1偏光サイトカインミリューにおいても一部のIL-4産生を保持することができることが望ましい特徴と思われる。この考え方に沿って、COVID-19を有する回復された患者において、最も高い血漿中和活性は、Th1およびTh2バイアス循環Tfh細胞の頻度の増加と関連していた[69]。この知見は、Th1-およびTh2バイアスTfh細胞がSARS-CoV-2に対する中和応答を形成するのに関連しており、これら2つの異なる機能型のTfh細胞の同時生成がSARS-CoV-2 mRNAワクチンの好ましい特徴となり得るという考えを強める。
3.2.3. 細胞傷害性T細胞応答
全体として、mRNAワクチンはCD8 T細胞応答を活性化する混合能力を有しているようです。我々は、マウスにおけるSARS-CoV-2 mRNAの単回投与が、脾臓および肺の両方において、IFNγ、IL-2および/またはTNF[23]の産生によって特徴づけられる多機能抗原特異的CD8 T細胞応答を引き出すことができると述べた。さらに、SARS-CoV-2 mRNAワクチンによって活性化されたCD8 T細胞は、細胞傷害性T細胞(Granzyme BおよびCD107a)の典型的なマーカーを有していた。独立した研究では、Luらは、ワクチン抗原による再刺激時のCD8 T細胞でのIFNγ産生によって測定された、SARS-CoV-2特異的CD8細胞のワクチン接種後のSARS-CoV-2特異的CD8 T細胞の有意な増加を発見した[44]。
mRNA臨床候補の前臨床試験はまた、小さくて大きな動物モデルにおける細胞傷害性T細胞の免疫後の誘導を調査し、いくつかの論争の結果を得た。BNT162b2マウス投与は、免疫後12日目に脾臓中のIFNγ-およびIL-2分泌CD8T細胞の量を増加させ、アカゲザルにミラーリングした結果である[12]。同様の知見は、CVnCoV[42]とラウチらによってCD8脾細胞で報告された。さらに、Zhangらは、臨床候補ARCoVを有するマウスのワクチン接種後、SARS-CoV-2特異的細胞に対して濃縮された可能性が高いCD8 Tエフェクター記憶細胞の有意な拡大を測定することができた[43]。一方、マウスでCD8 T細胞応答を引き出したModernaのmRNA-1273は、マカクの前臨床試験において検出可能なCD8 T細胞応答を誘導することができなかった。免疫原としてSARS-CoV-2 Sが使用されるワクチンに対するCD8 T細胞応答の欠如は、ヒトの自然感染とあまり似ていないが、Sタンパク質が比較的控えめなCD8 T細胞応答を一部のみで引き出すことが示されているが、COVID-19症例のすべてではない[70]。潜在的に有益であるが、ワクチン接種によるSARS-CoV-2に対する保護を成功させるために細胞傷害性CD8 T細胞の誘導が必要であるという兆候はない。+
4. SARS-CoV-2 mRNAワクチンによるヒト臨床試験の結果
ワクチンの有効性は、ワクチン接種された集団と予防接種を受けていない集団の比例疾患減少によって測定されることが多い[71]。ワクチンの有効性と数十年にわたるヒトワクチン研究から生まれた保護抗体の産生との間の強い相関関係を考えると、初期段階1/2研究は当初、ワクチン候補の有効性を定義するためにこの指標に依存していた。第2相および第3相臨床試験のデータが増えるにつれて、SARS-CoV-2 mRNAワクチンとCOVID-19からの保護との間に明確な相関関係が確立され始めている。
4.1. フェーズ 1/2
この記事を書いている時点で、モデルナとビオンテック/ファイザーの2人のワクチン開発者だけがSARS-CoV-2 mRNAワクチンに関する査読フェーズ1/2研究を発表しました。このため、他のmRNAベースのワクチン候補は現在開発中ですが、これら2つのワクチンメーカーからの臨床フェーズ1/2の報告にのみ焦点を当てます。
4.1.1. 有効性プロファイル: 体液性反応
国立アレルギー・感染症研究所とモデルナが共同開発したmRNA-1273の第1段階の研究では、45人の参加者が25、100、または250μgの25μgの2つの予防接種(プライムおよびブースト)を受けました。すべての参加者のセラは、完全なSおよびRBD特異的IgG結合力剤について酵素結合免疫吸着測定(ELISA)によって試験された。すべての用量群の参加者は、最初の予防接種の15日後に回復期のseraの中央値範囲内の100および250μgワクチン用量群からのS-2PおよびRBD特異的IgG抗体剤を用いて、抗SARS-CoV-2 抗体応答を開発した。抗原特異的IgG力素は、SARS-CoV-2回復セラコントロールの上部範囲にあるすべてのワクチン投与量群からのブースト後の増強力素の中央値で、ブースト後も増加し続けた。ウイルス中和は、擬似型レンチウイルスおよび野生型SARS-CoV-2を用いたインビトロ中和アッセイにより測定した。用量効果が観察された一方で、中和s抗体はすべてのワクチン群における2回目の免疫化後にのみ回復性血清の範囲のレベルに達し、堅牢な中和応答を促すプライムブースト免疫レジメンの重要性を示した。注意:100μg投与群からの参加者は、最初のワクチン接種後119日まで追跡された(90後ブースト)、わずかな減少にもかかわらず、中和抗体レベルはすべての参加者において有意に上昇したままである[11]。これらのデータは、mRNA-1273が持続性抗体応答を誘導する可能性があることを示唆している。ワクチン候補BNT162b1とBNT162b2は、ファイザーと共同でBioNTechによって共同開発されました。BNT162b1はSARS-CoV-2RBDタンパク質の分泌された三量体化されたバージョンをコードし、BNT162b2は先に述べたS-2P突然変異を有する全長Sタンパク質をコードする。BioNTechとファイザーは、ドイツのBNT162b1候補を持つ2つのフェーズ1/2傘試験を同時に開始し、もう1つはドイツのBNT162b1およびBNT162b2候補を持つ[14,15]。米国の試験では、参加者はBNT162b1およびBNT162b2の10、30、または100 μgでワクチン接種を行い、ドイツの試験では1、10、30、50、または60μgのBNT162b1の用量を試験した。BNT162b1の全ての用量は、最初のワクチン接種の21日以内にSARS-CoV-2回復血漿の範囲でRBD特異的IgG応答を惹起することができ、ブースト後の力力の増加を有する[13,14]。さらに、S結合IgG s抗体は、2回目の免疫後に比較的同等のレベルでBNT162b1とBNT162b2の両方によって誘導された[15]。Modernaの結果と同様に、両方のBioNTechのワクチンは、2回目の予防接種[13、14、15]の後にのみ、改変されたSARS-CoV-2レポーターウイルスを用いたインビトロ中和アッセイを介して測定された中和s抗体値をベースラインより大きく引き出した。これらのデータをまとめると、これらのデータは、SARS-CoV-2 mRNAワクチンが非常に低用量であってもSARS-CoV-2 IgG応答を誘導するのに有効であることを示している。しかし、いずれかのmRNAワクチン製剤の第2の用量は、中和s抗体の有意なレベルに達するために必要とされるようです。また、これらのヒト試験ではSARS-CoV-2結合IgG力素および中和抗体力素のみを測定し、ワクチン接種後のB細胞応答のより深い分析をヒトで行い、臨床データを動物実験で生成されたものと結びつける必要があることにも注意することが重要です。
高齢者人口(≥65年)は、年齢に伴う免疫感覚[72]によるワクチン開発者にとってユニークな課題を提起する。免疫応答の障害は、高齢の被験者のワクチンの有効性を低下させ、この集団がSARS-CoV-2感染時に重篤な病気になる可能性を高める可能性があります。実際、COVID-19による疾患の重症度と死亡率は、高齢者人口において特に高い[73]。これらの理由から、65歳以上の個人が特別な関心のグループとして研究されている。mRNA-1273の小相1用量エスカレーション試験では、40人の高齢者が年齢(56〜70歳または≥71歳)に従って階層化され、25または100μgのmRNA-1273のいずれかで2回予防接種を受けた。著者らは、2回の免疫の後に抗体応答を強く結合し、中和する両方の古いコホートで良好な反応原性プロファイルを発見した[9]。この研究のデータはまた、時間および用量依存性の傾向が以前に若いコホートで観察されたものと類似していたことを示唆している [6], そして、56歳以上の個人は、第二の免疫後、より高いワクチン用量(100 μg)に応答してより高い中和抗体応答を開発した。BioNTech/ファイザーの候補者は高齢者でも審査され、BNT162b1とBNT162b2の両方が、2回目の予防接種によって強化された高齢者の最初のワクチン接種後に抗原特異的IgGタイターを引き出した[15]。若いグループと同様に、中和抗体価の価数が若年者と比較して全体的に低かったにもかかわらず、中和s抗体産生を引き出すために高齢者グループでブースター予防接種が必要であった。ここでは、両社のデータはフェーズ1の試験であるため、各グループの少数の参加者が著者が有意義な統計的分析を行うことを妨げていることに注意することが重要です。
4.1.2. 有効性プロファイル: 細胞応答
先に述べたように、SARS-CoV-2 mRNAワクチンがTh1 CD4 T細胞応答を引き出すために望ましいと思われる。さらに、SARS-CoV-2特異的細胞傷害性CD8 T細胞の誘導も、免疫媒介性保護の余分な層を提供することができるので、有利であると考えることができる。第1相試験では、ModernaのワクチンmRNA-1273は、Th1サイトカインの産生に強く偏った測定可能なSARS-CoV-2特異的CD4 T細胞応答を示し、最小Th2サイトカイン産生[6,9]を示した。若年層と高齢者の両方の研究群において、これらの回答は、25μgの用量群と比較して100μgのmRNA-1273を受けている個体においてより高いように見えた。一方、SARS-CoV-2特異的CD8 T細胞応答は、このワクチン製剤に対するほとんどのワクチン接種者において、ブースト投与後でさえほとんど検出できなかった。この結果は、100μgの高用量であっても、前臨床試験中にアカゲザルでmRNA-1273を免疫した後に抗原特異的CD8 T細胞応答が見つからなかったことを考えると、驚くべきことではありません[7]。バイオテック/ファイザーのBNT162b1ワクチンは、SARS-CoV-2特異的CD4 T細胞応答を駆動することもできました [13].BNT162b1によって促進されたSARS-CoV-2特異的総CD4 T細胞は、SARS-CoV-2ペプチドによる刺激時に、IFNγおよびIL-2ではなくIL-2を産生するSARS-CoV-2特異的CD4 T細胞の頻度によって測定されるように、Th1機能プロファイルに向かって分極した。mRNA-1273とは異なり、BNT162b1は、試験対象の大部分でSARS-CoV-2特異的CD8 T応答を駆動することができた[13]。第1/2相データは、3.2.3に記載されている異なるmRNAワクチンに関するすべての動物研究と一致しており、したがって、mRNA-1273がSARS-CoV-2特異的CD8 T細胞応答を引き起こすことができない点でユニークであると思われるのに対し、他のmRNAワクチンは検出可能なウイルス特異的CD8 T細胞を誘導することができることを確認する。mRNA-1273が、より大きな動物モデルおよびヒトにおいて効果的なCD8 T細胞応答を促進できない理由は不明である。可能な貢献者は、SARS-CoV-2 mRNA設計またはLNPの処方である可能性があります。
4.1.3. 安全プロファイル
これらのmRNAワクチン候補は、比較的良好な安全性プロファイルを有する。mRNA-1273は、試験を停止するための基準を満たす第1相試験中に報告された重篤な有害事象を持っていなかった。報告された有害事象の中で、注射部位における局所的な痛みは一般的であったが、発熱、悪寒および頭痛を含む全身的な事象は、ブースター予防接種後および高いワクチン用量で増加した発生率および重症度で登録された[6]。高齢者集団にも同じ安全プロファイルが観察された[9].
BNT162b1およびBNT162b2の安全プロファイルはmRNA-1273[13、14、15]の安全性プロファイルと非常によく似ています。すべてのワクチン群は、最も一般的な有害事象として注射部位の痛みと圧痛を報告した。発熱、疲労および悪寒は、最も頻繁に報告された全身有害事象であった。反応原性は用量依存性であり、ブースト用量後により顕著であった。1回の予防接種時に高用量で報告された高い反応原性に基づいて、より低いワクチン用量でブーストした後、最初の100μg[14]または60 μg[13]用量を受けた参加者は2回目のワクチン注射を受けませんでした。重要なことに、BNT162b2は、特に65〜85歳の参加者において、BNT162b1よりも発熱や悪寒を含む有害事象が少なかった。BNT162b2の低い反応原性は、2つの候補の同等の免疫原性と共に、BNT162b2の後の第3相試験への進歩を支持した[15]。
4.2. フェーズ3試験
2020年12月30日現在、ビオンテック/ファイザーのmRNAワクチン候補BNT162b2とモデルナのmRNA-1273が、いずれも米国での緊急使用承認を承認されています。このように、一般の人々へのmRNAワクチン投与が開始された。SARS-CoV-2パンデミックを停止する必要がありますが、この決定では、フェーズ3研究の継続を混乱させる問題も生じます。もともとプラセボ対照群の個体も予防接種を受け、SARS-CoV-2ワクチン誘発免疫の長期的な二重盲検研究は不可能になる。
BioNTech/ファイザーは最近、ワクチンBNT162b2の安全性と有効性の両方について試験している2/3の臨床試験のデータを発表しました [16].この試験には約44,000人の参加者が登録されており、年齢は16歳から85歳までです。参加者は無作為に2つのグループに1:1の比率で分け、BNT162b2またはプラセボのいずれかを受け取った。注射は2回投与シリーズとして与えられ、それによってBNT162b2群は21日離れて2回30μgの用量を受け取り、プラセボ群は代わりに2回生理液注射を受けた。この2回投与免疫レジメンは、BNT162b2を受けた人の中で、8人だけがCOVID-19を発症したのに対し、プラセボ群では162例が報告されたことを引用して、COVID-19に対して顕著な95%の保護を与えた。BNT162b2は非常に良好な安全性プロファイルを示し、BNT162b2群の27%とプラセボ群の12%が有害事象を報告した。これらの事象は、注射部位の痛み、疲労、頭痛、発熱などの短期的な全身反応など、主に短期的な軽度から中等度の局所反応であった。
ModernaワクチンmRNA-1273も現在第3相臨床試験を受けており、そのデータは最近公表されている[10]。この試験は、18歳から85歳までの年齢を持つ約30,000人の参加者で構成され、1:1比で無作為に2つのグループに分割され、mRNA-1273またはプラセボのいずれかを受け取ります。すべての参加者は、28日で分離されたmRNA-1273または生理的プラセボの100 μgのいずれかの2回投与の注入系列を受けた。モデルナはmRNA-1273の94.1%の有効性率を報告した。mRNA-1273ワクチン群では11例のCOVID-19症例のみが報告され、プラセボ群では185例であった。このワクチンの安全性プロファイルも非常に良好であり、特定の安全性に関する懸念は特定されなかった。
現在、BNT162b2とmRNA-1273の両方が緊急使用承認のために承認されていますが、フェーズ3試験が完了していないことを覚えておくことが重要です。参加者は、ワクチンの安全性と有効性を完全に評価するために、今後数ヶ月、そして潜在的に数年にわたって監視され続けます。
5. SARS-CoV-2 mRNAワクチン候補の強みと限界
5.1. 強み
mRNAベースのワクチンは、多くの理由で進行中のSARS-CoV-2パンデミックと戦うためのますます魅力的なプラットフォームとなっています。まず、ワクチン候補を生成するために所望の抗原のDNAテンプレートのみを必要とし、非常に速い製造タイムラインを生じる[4]。第1のmRNAワクチン候補(mRNA-1273)の臨床試験は、2020年1月にSARS-CoV-2配列が公表されてからわずか66日後の2020年3月に始まり、2番目の候補(BNT162b1およびBN162b2)は1ヶ月後に第1/2臨床試験に入った[77]対照的に、従来のワクチンプラットフォームを利用したワクチン候補の開発は、これまでFDAによって緊急承認を与えられた唯一のワクチンがmRNAワクチンであるという事実によって示されるように、細胞株の開発、ウイルスの生成、および/または臨床グレードのタンパク質サブユニットの生産の本質的に遅い性質のために長い時間がかかっています。
第二に、mRNAワクチンは、第3条および第4節で広く議論されているように、動物実験およびヒト臨床試験の両方において非常に強力な免疫応答を引き出した。重要なことに、これらの強力な免疫応答は、第2/3の研究でCOVID-19からの印象的な保護によって実証される[10,16]。FDAは当初、SARS-CoV-2ワクチンは承認の資格を得るために最低50%の有効性を必要とすると述べているが[78]、緊急使用承認(mRNA-1273およびBNT162b2)のために現在承認されている現在のmRNAワクチンの両方が94%以上の有効性を報告した[10,16]。このレベルの有効性は、臨床試験における次に最も先進的なワクチン候補(ChAdOx1 nCoV-19)、アストラゼネカ/オックスフォード大学のアデノウイルスベクターワクチンが約70%有効であることを考慮すると、SARS-CoV-2ワクチンにとって非常に高い基準を設定します[79].
mRNAワクチンは、さらなる望ましい特徴を有する。他のワクチンプラットフォームと比較して、mRNAワクチンはミニマリストの性質のために魅力的です。mRNAワクチンは、その分娩/発現のためのベクターを必要としないため、既存および/またはノボ抗ベクター免疫の可能性のある合併症を取り除く[80]。不活性化または減衰ワクチンとは異なり、中和抗体生成をもたさない重要度の低い抗原標的は含まれない。ウイルスの増殖に関与する必要がないため、細胞株から他の汚染ウイルスの可能性が除去される。LNPにカプセル化されたmRNAワクチンは、DNAワクチンの要求に応じてエレクトロポレーションを伴う複雑な送達方法も必要とせず、タンパク質ワクチンに必要なアジュバントを添加する必要もありません。さらに、前述したように、すべての利用可能なデータは、mRNA-LNPプラットフォームがTh1バイアスに向かってT細胞を偏極することを示唆し、これらのワクチンがVAERD(セクション3.2.2で説明)などの有害事象を引き起こす可能性がかなり遠いと思われることを示唆している。
最後に、mRNAワクチンは必要性に基づいて容易に修飾することができる。標的免疫原性エピトープは、テンプレートとして機能する抗原のDNA配列が必要なため、候補の出入りが容易に行えます。SARS-CoV-2ワクチン構築物は、新たに出現したコロナウイルス株を標的に迅速に調整することができる[8]。
5.2. 課題と制限
これまでに生成されたすべての臨床データは、mRNAワクチンがヒトで安全に使用されることを示していますが、このタイプのワクチンがライセンスされたのはこれが初めてです。それでいくつかの潜在的な未知数が来る。例えば、COVID-19 mRNAワクチンによる免疫化後にアナフィラキシーを経験した人が最近報告されているのはまれである[81]。すべてのワクチンと同様に、ワクチンを構成する1つ以上の成分にアレルギー反応を起こす人もいます。現状では、このmRNAワクチンの問題成分が何であるかは不明であるが、アナフィラキシーは重度のアレルギーの既往歴を持つ人々にとって大きな懸念事項である。
もう一つの不確実性は、ヒトにおけるSARS-CoV-2 mRNAワクチンによって与えられる免疫の長さである。すべての前臨床データは、動物モデルにおいてこのプラットフォームによって引き出される長期的な免疫があるかもしれないことを示しているが、この点に対処するための拡張研究はまだ公表されていない。インフルエンザヘマグルチニン(HA)ベースのmRNA-LNPワクチンを利用した実験では、HA阻害力剤は、免疫後400日までマウスのわずかに減少することを示した[31]、このワクチンプラットフォームは、耐久性のある抗体応答を生成することができることを示した。現在までに、ヒトにおけるmRNAワクチン誘発s抗体の持続性は、初期免疫後119日までしか報告されていない[11]。しかし、これらのデータは、SARS-CoV-2特異的抗体力器がこの期間でわずかに衰え、このプラットフォームで長期的なワクチン誘発免疫の可能性を示していることを示している。
mRNAワクチンに必要な超低温貯蔵の必要性も懸念される。しかし、これらのワクチンは4°Cで1週間かなり安定している[43]という研究が示唆されている。現状では、mRNAワクチンBNT162b2の現在の貯蔵に関する推奨事項は、効力を維持するために、最大6ヶ月間−80°C〜−60°C、または最大5日間は2°C〜8°Cである[82]。モデルナワクチンmRNA-1273の貯蔵に関する推奨事項は若干異なっており、FDAは−25°C~−15°Cの長期保存を推奨し、2°C~8°Cで最大30日間保存することを推奨している[83]。多くの国の輸送と保管は乗り越えられない問題ではありませんが、遠隔地や発展途上国での広範な分布は、mRNAワクチンにとって非常に困難に見えます。
6. 結論
SARS-CoV-2ゲノム配列の放出からSARS-CoV-2 mRNAワクチン第1相まで数ヶ月以内に臨床試験を進め、ワクチン開発者にとって前例のない取り組みでした。通常、標準的なアプローチを用いたワクチンの開発は、効果的なワクチンがヒト用に認可されるまでに数年を要する。SARS-CoV-2 mRNAワクチンの開発が迅速化すると、手抜きに対する一般の懸念が生じ、安全性と有効性が深く評価される前にワクチンを一般に公開する恐れが生じます。本明細書において、前臨床および臨床研究においてワクチンによって引き出される適応免疫応答に重点を置いて、SARS-CoV-2 mRNAワクチンのあらすじを提供した。さらに、mRNAワクチンプラットフォームの長所と短所を打ち出しました。現在の臨床候補から公表されたデータは、このワクチンモダリティの有効性と安全性の高い程度を示しています。利用可能なデータに基づいて、mRNAワクチンプラットフォームは、ワクチンの開発と将来のパンデミックの準備の両方のためのパラダイムシフトを提供します。
補足資料
以下は、オンラインで入手できるhttps://www.mdpi.com/2076-393X/9/2/147/s1。
投稿者
E.BとM.L.は、オンライン文献検索を行い、原稿を書き、編集しました。●図.B用意しました。M.L.は、このレビュー記事の準備を監督しました。すべての著者は、原稿の公開版を読んで同意しました。
融資
M.L.はNIH NIAID助成金R01 AI123738およびR01 AI153064によって支えられている。
利益相反
著者らは利益相反を宣言しない。
略語
血液型 抗体
エース2 アンジオテンシン変換酵素 2
APC 抗原提示細胞
covid-19 コロナウイルス病 2019
Δフラン ふるん切断部位を欠いているフルレングスS
DC
エリサ 樹状細胞
酵素結合免疫吸着測定法
GC
ハ 胚中心
ヘマグルチニン
Ig 免疫グロブリン
イリノイ インターロイキン
LLPC 長命のプラズマセル
LNP 脂質ナノ粒子
m1Ψ N1-メチル-シュードリジン
MBC メモリ B セル
mRNA メッセンジャーRNA
掻っ攫う 中和抗体
RBD 受容体結合ドメイン(SARS-CoV-2Sの)
リグ-I レチノイン酸誘導性遺伝子I
rRBD 組換えRBD
rRBD-アダヴァックス アジュバント・アッダヴァックスで与えられたrRBD
S スパイクタンパク質(SARS-CoV-2)
S-2P スパイク2-プロリン(アミノ酸986および987におけるプロリン置換を有するSARS-CoV-2 S;前核構造で安定化)
S1 サブユニット 1 (SARS-CoV-2 S)
S2 サブユニット 2 (SARS-CoV-2 S)
SARS-CoV-2 重症急性呼吸器症候群 コロナウイルス2
Rf. T濾胞ヘルパー細胞
Th1 T ヘルパー 1
Th2 T ヘルパー 2
TLR トール様受容体